식약청, 제네릭 의약품 2012년 상반기 개발동향 분석
식품의약품안전청(청장 이희성)은 2012년 상반기 제네릭의약품 개발을 위한 생물학적 동동성시험계획서 승인 현황을 분석한 결과, 총 108건으로 전년 상반기(114건)에 비하여 소폭 감소했다고 밝혔다.
전체 승인 품목 중 고혈압치료제인 발사르탄·암로디핀베실산염 복합제와 로사르탄칼륨·히드로클로로티아지드 복합제가 전체 품목 중 27 %를 차지해, 고혈압치료제 복합제의 개발 열기가 높은 것으로 나타났다.
이는, 우리나라가 고령화 사회로 변화되면서 단일제만으로 혈압조절이 어려운 만성 고혈압 환자들이 증가해서 고혈압 복합제 개발이 활발하게 진행하고 있는 것으로 보여진다.
생물학적동등성시험은 오리지널 의약품과 효능·효과가 동등하다는 것을 증명하는 시험으로, 시험을 실시하기 위해서는 식약청에 생동성시험 계획서를 제출하여 승인을 받아야 하며, 동 계획서 승인현황을 통해 향후 제네릭의약품 개발동향이 예측 가능하다.
식약청은 올해 상반기 생동성시험 계획서 승인건수를 분석한 결과 재심사가 만료된 의약품을 중심으로 신청이 늘어나고 있는 추세이며 특히, 고혈압치료제 복합제 개발이 두드러져 고혈압치료제인 엑스포지정®의 제네릭의약품인 발사르탄·암로디핀베실산염 복합제가 27건으로 생동성시험 승인 1위를 차지했다.
그 뒤로 위궤양치료제인 스토가정®의 제네릭의약품인 라푸티딘(7건), 주의력 결핍·과잉행동 장애(ADHD) 치료제인 스트라테라캡슐®의 제네릭의약품인 아토목세틴염산염(5건)이 각각 2위와 3위를 기록했다.
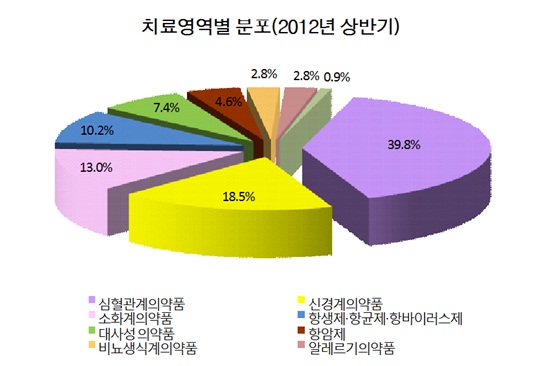
엑스포지정®은 ‘13년 4월, 스토가정®및 스트라테라캡슐®은 ’12년 9월에 재심사가 만료되는 품목으로 이처럼 재심사가 만료되는 의약품이 제네릭 개발 품목의 43%를 차지하고 있는 것으로 보아 국내 제약사들의 의약품 개발이 여전히 재심사가 만료되는 신약의 복제에 집중되고 있는 것으로 분석된다.
상반기 생동성시험 승인 품목 중 최초로 제네릭의약품 개발이 진행하는 품목으로는 치매치료제 리바스티그민(2건) 및 메만틴염산염(1건)과 위궤양치료제 이르소글라딘말레산염(1건) 4건이 포함되어 있다.
반면에 글리메피리드·메트포르민염산염 복합제에 힘입어 지난해 상반기에 가장 많이 승인된 당뇨병치료제의 경우(34%), 올해에는 약 7%(8건)으로 전체 개발 품목 비중이 크게 감소했다.
식약청은 최근 개발되는 제네릭의약품은 고혈압, 고지혈증 또는 치매 등 고령화 사회에서 발병률이 크게 증가하고 있는 만성질환에 개발이 집중되고 있으며, 이러한 경향은 앞으로도 계속 될 것으로 보이다고 설명했다.

